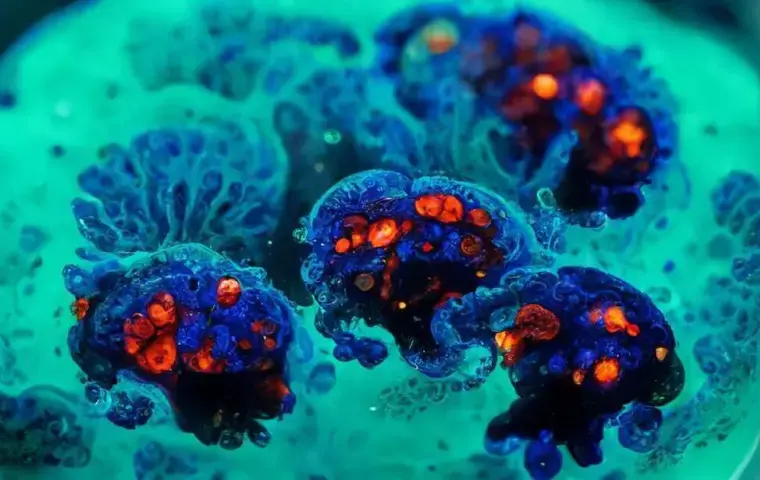
转化肿瘤学模型
PDXO 模型填补了传统模型之间的空白:一端是速度快但预测性有限的肿瘤细胞系,另一端是转化相关性高但资源投入巨大的 PDX 试验。依托冠科生物庞大的 PDX 库,相较仅基于 PDO(患者来源类器官)的集合,PDXO 可覆盖更广泛的肿瘤适应症、遗传背景以及药理学数据。
- 相较全新的患者来源模型(de novo PDX/PDO),模型构建更快、成本更低
- 减少动物使用量,更好契合 3Rs 原则
- 可灵活搭建共培养体系,引入基质细胞或免疫细胞
- 具备工程化改造能力,支持更深入的机制研究
- 在研发早期即采用高临床相关性的模型,实现从体外到体内的平滑过渡,并保持高度匹配、可转化的系统
研究设计选项
常见问题解答
PDXO 是如何建立的?
PDXO 源自在 PDX 小鼠模型中扩增的患者肿瘤组织,并在体外建立类器官培养,从而保留肿瘤的关键生物学特征。
PDXO 如何与 PDX 模型形成最佳互补?
PDXO 可在进入 PDX 体内验证前,提供更快速、成本更低的体外筛选平台,从而提高候选方案进入体内研究时的确定性与效率。
PDXO 是否可以进行工程化改造?
可以。PDXO 支持基因水平的工程化改造,也可与基质细胞或免疫细胞建立共培养体系,用于更深入的机制与耐药研究。
准备好开始了吗?
了解匹配的体外与体内模型如何提升研究效率和结果的预测性。