人源化和转基因小鼠模型
通过在重建人类免疫功能、模拟患者‑肿瘤相互作用的模型中测试免疫肿瘤(IO)疗法,提高临床成功预测度,获得传统小鼠体系无法提供的关键答案。
为什么选择人源化小鼠模型?
人源化小鼠能够在体内直接评估仅对人类起作用的免疫治疗药物,这是传统小鼠体系无法实现的。通过在具有完整免疫系统的小鼠体内工程化表达人源药物靶点(如免疫检查点蛋白),此类模型在保持高度机制相关性的同时,提供了一种相较于全人源免疫系统模型更高效、转化相关性更强的替代方案,尤其适用于研究抗体联合方案、免疫记忆以及检查点抑制剂。
人源化小鼠模型可帮助团队:
- 借助人源化受体和配体,在体内研究广泛的人类免疫治疗靶点;
- 在小鼠同源蛋白缺失或功能缺陷时,仍可评估药物并确保靶点被有效占据;
- 在保留关键作用机制洞察的前提下,相比人免疫系统(HIS)模型显著降低成本和实验复杂度。
用于免疫治疗评估的人源化靶点携瘤模型构建
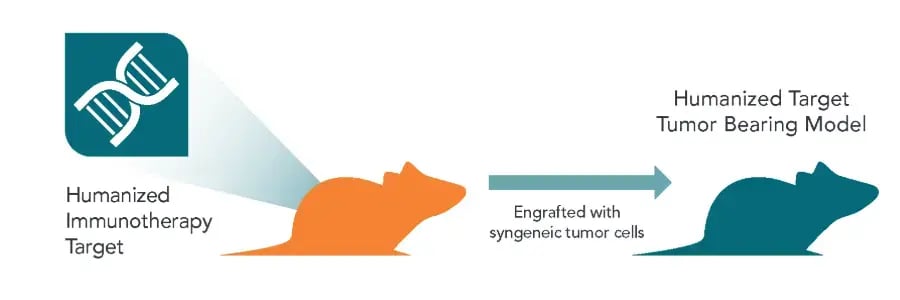
用于 IO 药物开发的人源化小鼠模型
观看本网络研讨会,了解以下内容:
- 用于体内肿瘤学研究的人源化小鼠模型
- 在人源化小鼠中评估免疫肿瘤(IO)治疗方案
- 在人源化小鼠平台中移植细胞系异种移植(CDX)和患者来源异种移植(PDX)模型的方法与实践
常见问题
同系模型是被工程化表达人源配体的同系肿瘤细胞系,与人源化、基因修饰小鼠模型联用时,非常适合用于评估肿瘤与免疫系统之间的双靶点相互作用,为免疫联合治疗方案提供更具说服力的体内证据。
冠科生物现有的人源化靶点组合涵盖 PD‑1、PD‑L1、CTLA‑4、CD137、TIGIT、OX40、LAG3 等多种关键免疫检查点和共刺激分子,并在持续扩充管线,为您的 IO 靶点验证与联合策略开发提供更丰富的选择空间。
主要应用包括:在体内验证免疫检查点抑制剂疗效、优化联合给药策略、研究免疫记忆建立与维持,并通过 TIL 分析和 FACS 流式检测深入评估免疫细胞浸润情况,为免疫肿瘤药物从机制研究到临床转化提供系统证据。
与全人源免疫系统(HIS)小鼠相比,此类人源化靶点模型在保持高转化相关性的同时,更具成本效率:构建周期更短、对专用设施和资源依赖更低、动物与试验物资投入更少,从而在不牺牲科学质量的前提下显著提升项目性价比和推进速度。
在常规肿瘤疗效终点(如肿瘤生长抑制率、生存期等)基础上,可同步叠加多维免疫与机制读数:包括流式细胞术与 TIL 分析的免疫谱系解析、生物标志物发现以及药效动力学(PD)指标,从而对候选 IO 药物进行更全面、可转化性更强的评估,为后续临床决策提供坚实数据支持。
准备好开启
您的免疫肿瘤研究了吗?
即刻启动项目,加速 IO 方案从概念到临床的转化进程。